近日,bat365在线平台官方网站、海洋生物制备技术国家地方联合工程实验室陈铭教授团队在皮肤疾病治疗领域取得重要进展,研究成果以“Mesoporous silica coated spicules for photodynamic therapy of metastatic melanoma”为题发表于Journal of Nanobiotechnology。研究团队创造性地将介孔二氧化硅修饰到蜂海绵骨针(SHS)表面,研发了一种用于经皮给药的新型分散型微针(mSHS)技术,利用其携载光敏剂PpIX成功实现了小鼠体内转移性黑色素瘤的完全治愈。该研究推动了经皮给药制剂的创新和发展,对转移性黑色素瘤等多种皮肤疾病治疗具有重要科学意义。
研究背景
转移性黑色素瘤是一种具有高度侵袭性和致死率的恶性肿瘤,其传统治疗方案并不理想。手术切除可抑制和损害淋巴细胞和自然杀伤细胞的免疫功能,进而导致肿瘤细胞的扩散或转移,化疗和放疗常会对骨髓产生明显的毒性。光动力疗法是一种针对恶性肿瘤的免疫增强疗法。在光敏剂递送方面,皮肤给药比全身给药(静脉注射或口服给药)有诸多优点,包括直接进入病变部位、减少光敏剂剂量、避免全身皮肤光毒性、患者依从性好等。然而,角质层屏障限制了大多数药物渗透至皮肤深层。传统的光敏剂如原卟啉IX( Protoporphyrin IX ,简称PpIX)通过使用乙醇或不同脂体系统可以增强其皮肤渗透效果,但倾向于聚集在角质层,到达皮肤深层的甚少。因此,将疏水性光敏剂输送到皮肤深层,对于转移性黑色素瘤治疗仍然是一个重大挑战。研究团队基于此难点研究出了一种介孔二氧化硅涂层修饰的蜂海绵骨针(mSHS),促进难溶性光敏剂传递进入皮肤深层,以消除转移性黑色素瘤(图1)。
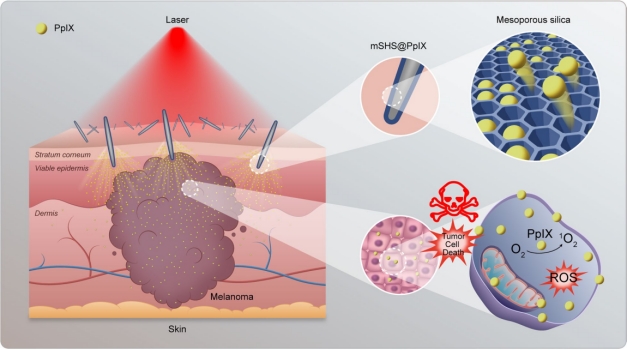
图1. 局部应用介孔蜂海绵骨针(mSHS)装载PpIX治疗转移性黑色素瘤
研究亮点
研究团队利用经典的表面活性剂模板合成方法在SHS表面构建一层介孔二氧化硅,制备了新型分散型微针mSHS(图2),通过调节关键反应底物,实现介孔二氧化硅层厚度的灵活控制。同时,提出可以物理混合不同载药mSHS从而构建出多药携载mSHS,实现经皮联合递送多种药物的协同治疗。实验表明,将难溶性光敏剂PpIX 装载至 mSHS 的介孔二氧化硅涂层中 (mSHS@PpIX), 不仅大大提高了局部给药系统中PpIX的载药量,还实现了难溶性光敏剂PpIX的皮肤深层递送。(图3)。
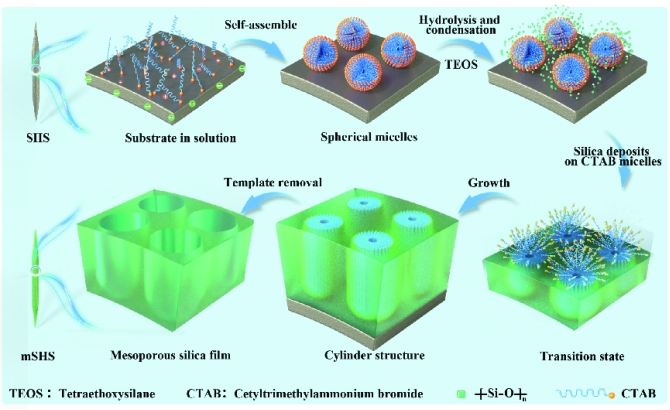
图2. mSHS的制备

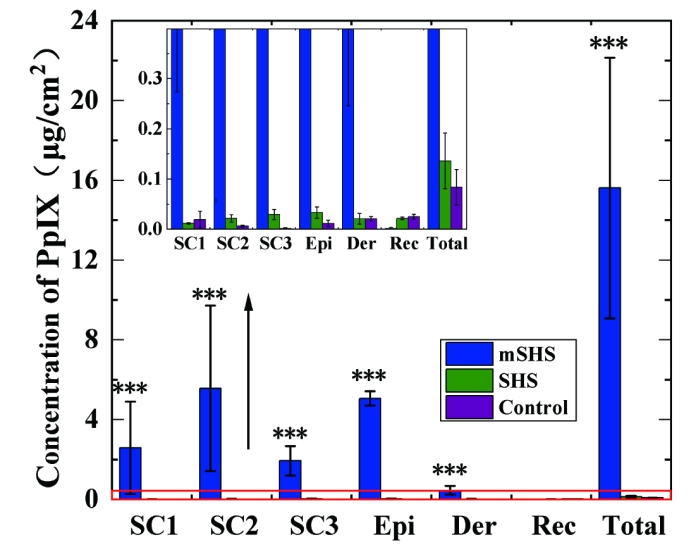
图3. mSHS实现PpIX的皮肤深层递送
研究团队进一步探究了mSHS@PpIX治疗小鼠体内转移性黑色素瘤的效果。结果表明,接受其他治疗方案(静脉注射、普通海绵骨针递送、乙醇涂抹)的小鼠均表现出持续的肿瘤生长,而mSHS@PpIX治疗后,小鼠体内实体瘤组织完全消失,且经治疗后的皮肤在30 天内逐渐恢复正常。mSHS@PpIX组小鼠全部存活,且没有肿瘤转移或复发(图4),表明这种新型微针递送光敏剂技术的安全性和有效性。但由于小鼠体内黑色素瘤存在高度转移和扩散的特点,远处转移性黑色素瘤的治疗也是未来的一大挑战。在未来的研究中,可以尝试用mSHS同时负载多种药物(例如PDT联合免疫疗法)来治愈原发性和转移性黑色素瘤。
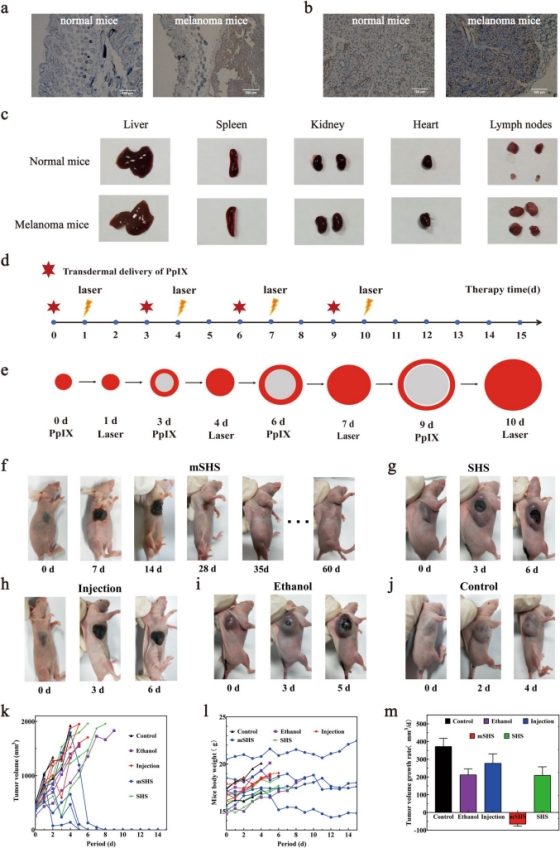
图4. 使用 mSHS@PpIX的光动力疗法在体内完全根除原发性黑色素瘤
研究团队及资助
该论文共同第一作者为bat365在线平台官方网站硕士毕业生梁雪娇(现为南京大学博士生)和福建医科大学肿瘤临床医学院张佳良博士,通讯作者为bat365在线平台官方网站陈铭教授。该研究获得深圳市科技计划项目(JCYJ20210324121800003)、厦门市海洋与渔业发展基金(21CZP002HJ05)和我校平潭研究院基金(Z20220791)的联合资助。
论文来源
Xuejiao Liang, Jialiang Zhang, Chi Zhang, Haojie Zhai, Ping Yang, Ming Chen. Mesoporous silica coated spicules for photodynamic therapy of metastatic melanoma. J Nanobiotechnology. 2024 Apr 15;22(1):179. doi: 10.1186/s12951-024-02471-y.
论文链接
https://pubmed.ncbi.nlm.nih.gov/38616270/
供稿:陈铭团队
编辑:苏颖
审核:陈芳奕、徐鹏、陈向柳